· 原子間の結合 が再構成されても、原子単位での質量に変化はない。 発生する水素量の測定:反応物がすべて生成物に変化したと考えて得られる理論的な数値が計算値である。例えば、1 molのマグネシウム(243g)からは、1 molの水素4 L(標準状態)が得られることになる。実験では、水素を水上置換で気体として得て、その時の気圧 · 原子間の 結合 が再構成されても、原子単位での質量に変化はない。 発生する水素量の測定:反応物がすべて生成物に変化したと考えて得られる理論的な数値が計算値である。例えば、1 molのマグネシウム(243g)からは、1 molの水素4 L(標準状態)が得られることになる。実験では、水素講義 物質1モルを構成している原子の数 第4回 講義と演習 化学変化に伴う量の関係 (モルを使って、実験1の考察を行う) 第5回 「モル」を理解するためのモデル実験 第6回 実験2 マグネシウムと塩酸の反応により発生する水素の体積の測定 講義 気体1モルの体積 化学変化で発生する気体の体積

新編改訂化学基礎 ダイジェスト版
マグネシウム 原子量 実験
マグネシウム 原子量 実験-1 乾いた試験管の質量(W1)を測定し,その中に酸化銅(II)1.00gを入れて,再び試験管全体の質量(W2)を測定する。 2 試験管に亜鉛を底から3cmほど入れ,図のような装置を組み立てる。 3 酸化銅(II)をできるだけ均一に広げる。 酸化銅(II)が誘導管につかないように取り付ける。 4 6mol/Lの塩酸を亜鉛の入っている試験管にの半分くらいまで加え,すばやく誘導ることを実験結果から見いだすことをねらいとしている。 この実験でマグネシウムを用いると,燃焼にともなっ て,熱や光を出すので生徒の興味・関心を高めるが,質量 の変化では誤差が生じる要因が多く,比例関係が見いだし にくい。データをひとつの班でそろえるには授業時間の制




マグネシウム Magnesium にがりの成分から軽量化合物材料まで Chem Station ケムステ
· 化学の実験方法について質問です。 マグネシウムと塩酸を用いてマグネシウムの原子量を求めるのですが、授業では自分たちで実験方法を考え使う器具なども自分たちで考えて実験をします。 水上 置換法で行うのかなっと思うのですがそれからが分かりません。教えて下さい。よろしくお(2) マグネシウムを熱したときにできる 物質の物質名を答えよ。 (3) この実験の化学変化を化学反応式で 表せ。 (4) この実験で,マグネシウムをステン レス皿全体にうすく広げて加熱する のはなぜか。 · マグネシウムの還元&酸化反応 永遠の定番実験! マグネシウムの還元&酸化反応 元素記号Mg、原子番号12番の元素。 マグネシウムは海水や岩石、生体の中などにも多く含まれ、にがり(主成分は塩化マグネシウムMgCl 2 )や便秘薬(主成分は酸化マグネシウムMgO)にも含まれていることからも身近であろう。 血液に含まれる赤い成分ヘム鉄によく対比さ
「原子量,分子量,式量,物質量」では48%「化学変化の CaSOの式量 69, 4 量的関係」では39%が「よくできた「だいたいできた」と H1molの質量 56, 」 2 答えた。分子量,式量,物質量についての確認テストを行っ O 60 2 10個の物質量 3722マグネシウムの質量(g) 12 24 36 48 60 72 84 実験後ビーカー全体の質量(g) 861 872 8 4 906 918 930 この実験の化学反応式を書きなさい。 マグネシウムを84g入れたときの実験で溶け残ったマグネシウムを全て溶かすためにはこの実験で用いたものと同じ濃度のうすい塩酸が少なくとも何cm 3 必要マグネシウムと塩酸が反応して、塩化マグネシウムと水素ができる実験を行います。 化学反応式は次のとおりです。 Mg + 2HCl → MgCl 2 + H 2
原子吸光分光光度法によるマグネシウム,カ ルシウムの定量に関する基礎的条件の検討を行ない,こ れをスラッグ中のマグネシウム,カ ルシウムの定量に応用したマ グネシウムの測定条件は,波 長285 憩μ,hollow cathode lampの 電流値30mA,空 気圧11kg/cm2,ア セチレン圧048kg/cm2が 最 適で,カ ルシウムの測定条件は波長422mμ,hollow cathode lampの 電流値50mA, 空気圧11kg/実験で教える化学基礎 ―原子量・極性・プラスチックの繊維― 都立新宿山吹高校 松本隆行 1.相対質量と原子量(BB 弾によるモデル実験) 2.共有結合の極性(磁石によるモデル実験) 3.プラスチックを繊維にする(溶融延伸) 目指したこと 実験で教える・実験で考える 短時間で行える覊 実験のポイン ト 購響繋叢醜纏饗鷲蠡黐驫華讐難蠶論鐶韈 この実験で は,塩酸 (1価の強酸〉,硫酸 (2価の強酸),酢 酸 (1価の弱酸)の等モル濃度の水溶液を同体積ずつ取り,過 剰量のマ グネシウム と反応させる。そして,発生した水素を水 ..
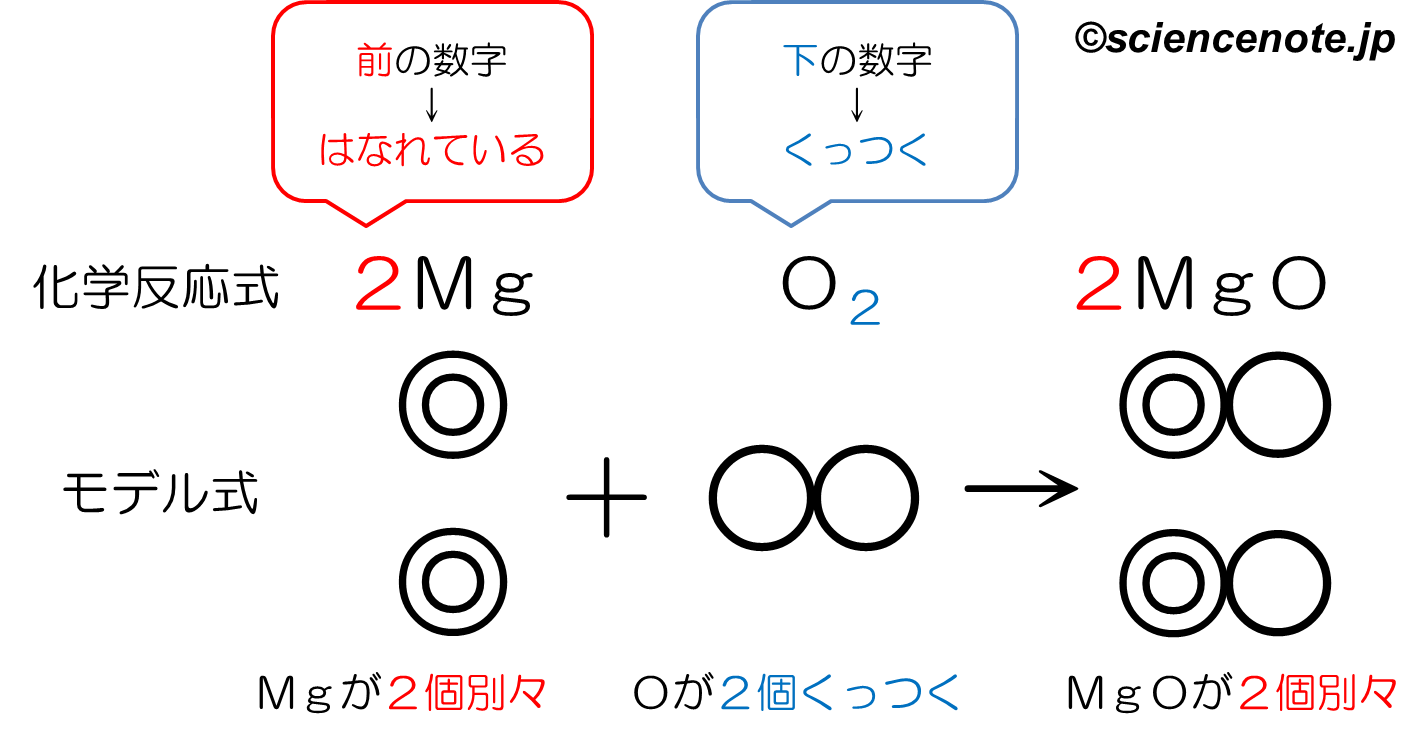



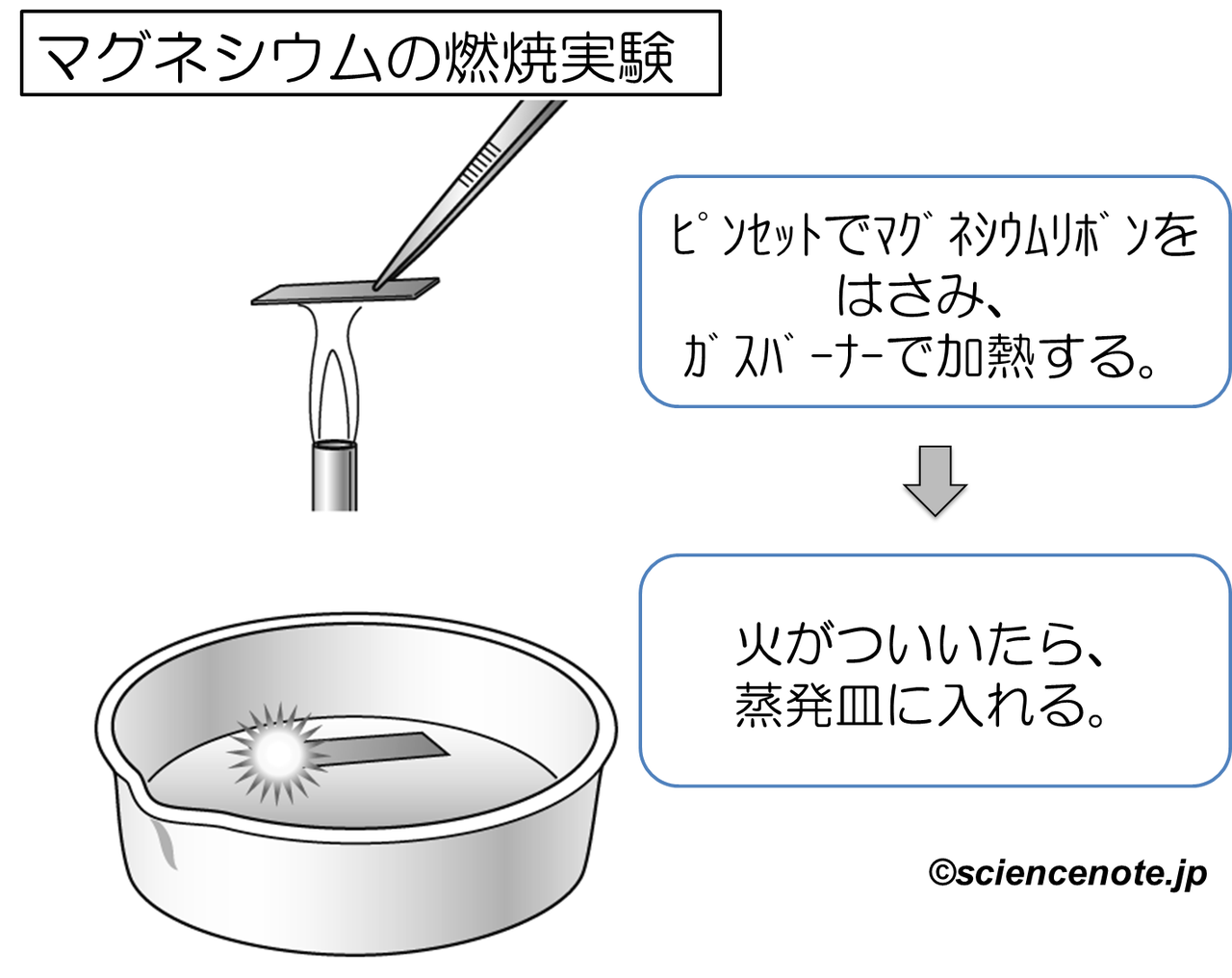
中2化学 マグネシウムの燃焼 Sciencenote Jp




マグネシウム Wikiwand
分析化学実験マニュアル ~各種滴定法・イオン交換法~ 注意事項1 試薬の役割等、考察事項は基本的に調べれば出る! 『Wako』や『同仁化学』のサイトから各試薬を調べれば情報アリ 注意事項2 原子吸光の使用方法は別資料のマニュアルで確認! · 原子量がHが1、Cが12、Oが16なので ・ C2H6O (エタノール)の重さを12×2+1×6+16= 46g とします。 ・ 3O2 (酸素)の重さは3×16×2= 96g となります。 ・ 2CO2 (二酸化炭素)の重さは2(12+16×2)= g となります。 ・ 3H2O (水)の重さは3(1×2+16)= 54g となります。 以上から反応の際の重さの比は、 エタノール : 酸素 : 二酸化てろ過後,マグネシウム定量用試験液とした. マグネシウム濃度の測定は,マグネシウム定量用 試験液05 mL に02 mol/L 酸化ランタン2mLを 加え,さらに水を加えて正確に50 mL とし試料溶 液とした.この試料溶液を原子吸光光度計




マグネシウムと酸の反応 らくらく理科教室




Amazon 元素標本 マグネシウム Mg 10mm角キューブ 刻印aタイプ 岩石 鉱物 おもちゃ
化マグネシウム量に関わらず,ほぼ100%であった. しかし,イオン線を用いると65%から44%に大きく 減少した. 本実験で測定した元素(Cd,Cu,Pb,Zn,Au,Be,In)にお いて回収率が低下する傾向は,中性原子線よりイオ ン線のほうが大きく,酸化マグネシウム量が多くな ると中性原子線とイオン線の仮定した場合(高摂取量)の見積もりは8 mg/人/日であった。ミネラルウォ ーター類及び水道水からのマグネシウムの推定一日摂取量は、平均的な見積も りは133 mg/人/日、高摂取量の見積もりは131 mg/人/日であった。 ただし,一度に使用するマグネシウムの量は 050 g 以下,酸化マグネシウムの量は 100 g 以下とする。また,塩酸(100 mol/L)の密度は 102 g/mL,実験での水溶液の 比熱は 418 J/( g・℃),水素,酸素,マグネシウム及び塩素の原子量はそれぞれ 10 0, 160,243,355 とする。




楽天ブックス 理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 本




理科実験のページ 埼玉県立松山高等学校
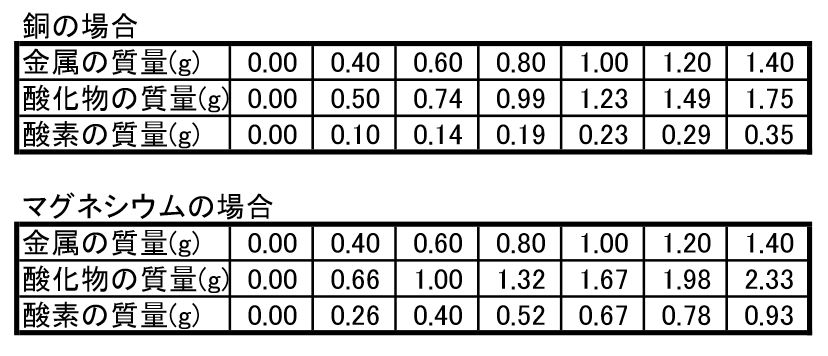
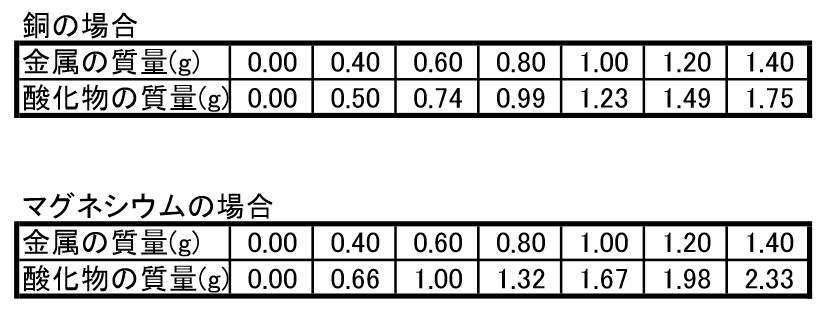
マグネシウムの質量を一定量ごとに量り,加熱しました。マグネシウムと,マグネシウムを加熱したときにできる物質は以下のとおりになり,比例関係にあることが分かりました。 マグネシウム 06gのとき 加熱後の物質 10g; · 2年生 二酸化炭素中で燃えるマグネシウムの実験の様子。(酸化還元) 中学理科2年生 二酸化炭素の中でマグネシウムがどのように燃えるかの実験です。実験1では酸化マグネシウムが,実験2では酸化銅ができた。酸化マグネシウムと酸化銅は,それ ぞれ金属原子の数と酸素原子の数が1:1の割合で結びついている。 問1 次の図2は実験1,実験2で使ったガスバーナーです。ガスバーナーに点火してから炎の大きさと 色を調節するまでの操作について




ウ の解説をお願いします 答えと解説も載せておきます Clear




問2なんですがどこが間違っているのか分からないので知りたいです Clear
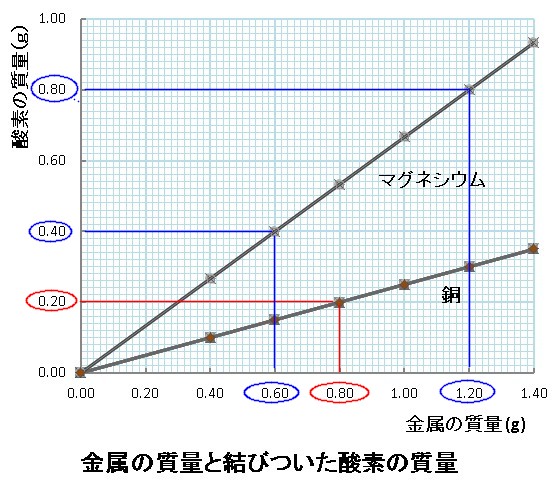
なるため Mg の原子量24とすると,0.Ol25×24=O.30 gに なる 。 ここで行う計算をみればわかるように,気体1mol の体 積を24L にすると,偶然Mgの 原子量が24であるため消 「金属を塩酸と反応させて気体を発生させる」という実・マグネシウムと酸素の質量は比例の関係であ る。 ・マグネシウムの量を増やすと、化合する酸素 の量も増える。 グラフから、マグネシウムの質量と酸素の質 量の関係は比例であると説明できる。(科学的 な思考) 分子原子27分子量というのは分子内の原子量の和 マグネシウム(元素記号Mg,原子番号12)の特性について解 に原子量の変動範囲₁₀₀₇₈₄~₁₀₀₈₁₁,次に「原子量表(₂₀₁₀)」の値₁₀₀₇₉₄±₀₀₀₀₀₇が示されており,その下に




Pdf Wettability Of Molten Magnesium On Carbon And Aln



アボガドロ数の測定法
原子吸光法による粉乳中の微量ヒ素の定量法について (昭和50年9月17日 受理) 実験操作 31 試料の前処理 マグネシウム塩の添加量 粉乳の乾式灰化において添加する硝酸マグネシウムの 適量につき検討したヒ 素標準液5mlを 添加した粉乳 1gに 対し,50%硝 酸マグネシウム溶液を05, 1, 2, 3,おを題材として、以下の実験仮説を立てた。 仮説弱塩基の水酸化マグネシウムは、わずかに水に溶けて下に示すように2段階に電離し、 第1段階(①式)の電離度は1で、第2段階(②式)の電離度は第1投階に比べて小さいとする。 2 実験 2.1 準備 mol/lの水酸化マグネシウム飽和水溶液、0前述までの実験で,化合する酸素の質量 は理論値に近いものになった。しかし,得 られた酸化マグネシウムの色は灰色で(窒 化マグネシウムの色なのか黄色なども見ら れ,真っ白とは言い難いものであった。) そこで,酸素の供給を十分にすれば,化合




3 pi Oa 10ml 4060g 1co Lihat Cara Penyelesaian Di Qanda




00 号 アルミ合金の溶湯中のマグネシウムの含有量を測定する法 Astamuse
マグネシウム 12gのとき 加熱後の物質 g;Mg マグネシウム(Magnesium) 原子番号:12 原子量: 意外と身近な軽金属元素 マグネシウムは非常にポピュラーな元素で、地球表層部の元素存在度(クラーク数)が8番目に大きい元素である。マグネシウムは電気陰性度が高く非常にイオンになりやすいので天然には単体として産出しない




Omg マグネシウム Mg 周期表 Zazzle Co Jp




マグネシウム Wikipedia




最新物質 の 質量 の 求め 方 最高のぬりえ




マグネシウムと塩酸の反応についての問題 マグネシウムと塩酸の反応で 水 Okwave
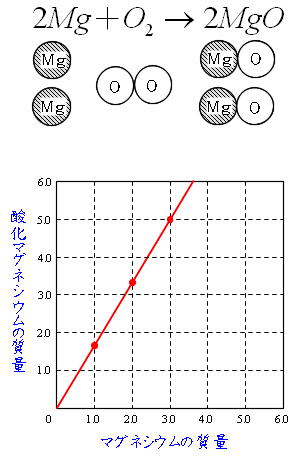



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ




マグネシウム Magnesium にがりの成分から軽量化合物材料まで Chem Station ケムステ
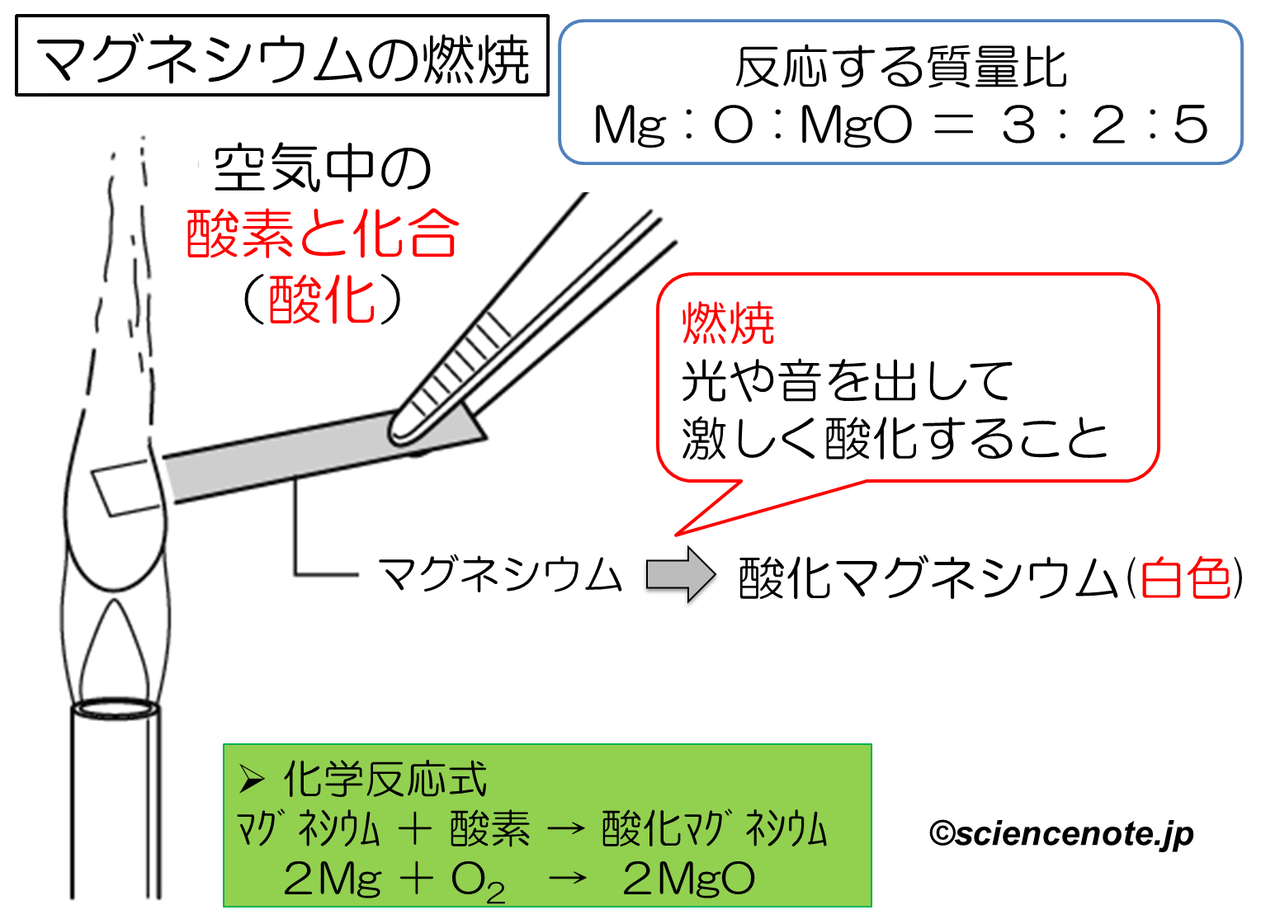



中2化学 マグネシウムの燃焼 Sciencenote Jp



マグネシウム の評価や評判 感想など みんなの反応を1時間ごとにまとめて紹介 ついラン
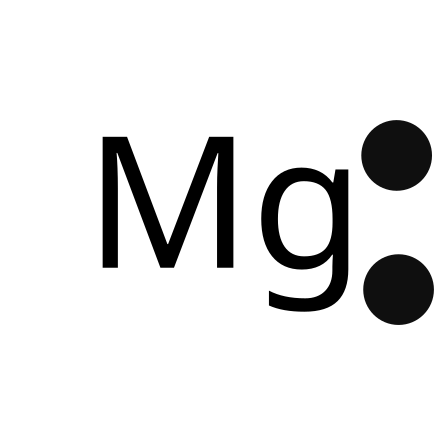



マグネシウム Wikiwand




18 号 マグネシウム含有オキシトシン製剤および使用の方法 Astamuse




中学2 3年理科の化学計算 ゴロ合わせで化学を楽々制覇 その 原子量 水の電気分解 金属の酸化と燃焼 Studygeek スタディーギーク




マグネシウムと塩酸の反応についての問題 マグネシウムと塩酸の反応で 水 Okwave




新編改訂化学基礎 ダイジェスト版




問3の解き方教えて欲しいです 答えは27になるみたいです Clear




Amazon 元素標本 マグネシウム Mg 10mm角キューブ 刻印aタイプ 岩石 鉱物 おもちゃ




化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で




1g 1 80g Descubre Como Resolverlo En Qanda




元素 Minecraft Wiki



貴金属の実験 貴金属とは 産出量が少なく 伝統的 商業的に価値のある 貴重な 金属 のほかに 腐食せず外観が変わることがないといったような 化学的に 貴な 金属 という意味合いもある 予備実験 金 白金 ロジウム溶液のマグネシウム



理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 編集 学術図書出版社 版元ドットコム




1g 1 80g Descubre Como Resolverlo En Qanda




Pdf Electron Microprobe Analysis Of Mg Ge Alloy Examination Of The Mass Absorption Coefficient Of Ge For Mg Ka



マグネシウム の評価や評判 感想など みんなの反応を1時間ごとにまとめて紹介 ついラン




マグネシウム Wikipedia



中学理科 2 教えてください 1 で 銅 酸素 4 1となっているは Yahoo 知恵袋




楽天ブックス 理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 本




化学の質問です 写真のような条件で実験し 反応物の過不足を考える時 化学 教えて Goo




永遠の定番実験 マグネシウムの還元 酸化反応
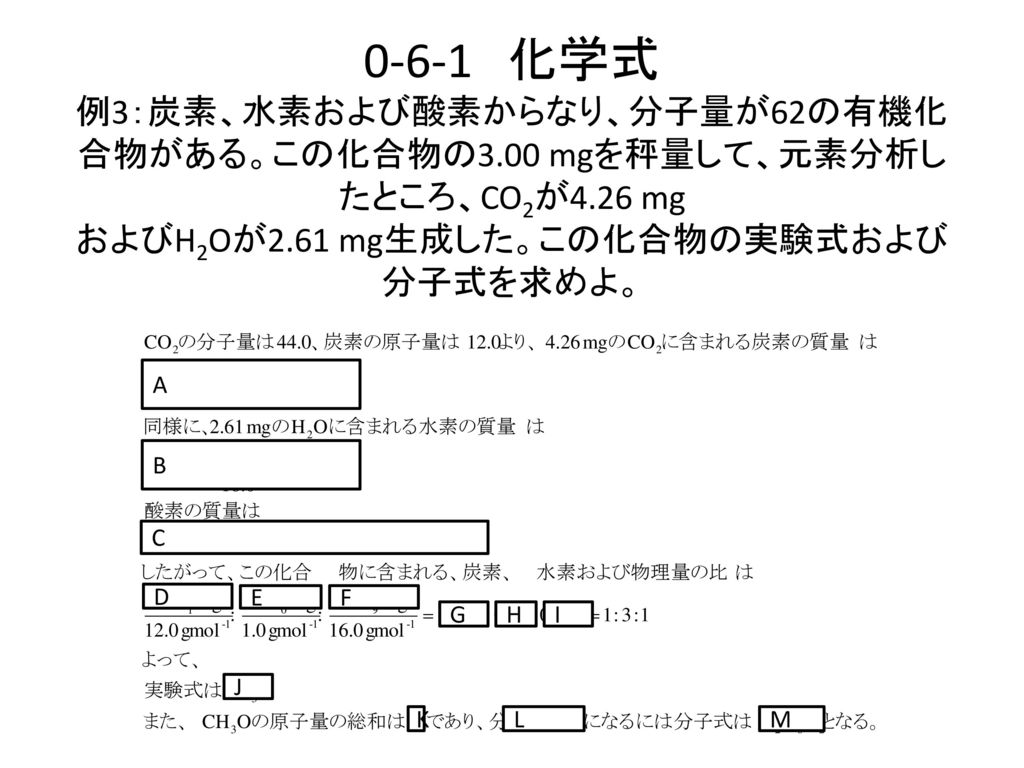



福井工業大学 工学部 環境生命化学科 原 道寛 名列 氏名 Ppt Download




問いの4番です 原子量を使わずに解く方法はありますか よろしくお願いします Clear




臭化マグネシウムmgbr2やヨウ化カリウムkiの酸化 海水中のbr やi Clear




とりあえず水をカスタムしてみた Roast Design Coffee Blog




改訂化学基礎 改訂化学 ダイジェスト版




Microsoft Word 化学実験 工 先進工 共通 テキスト 第3q Docx Pdf Free Download
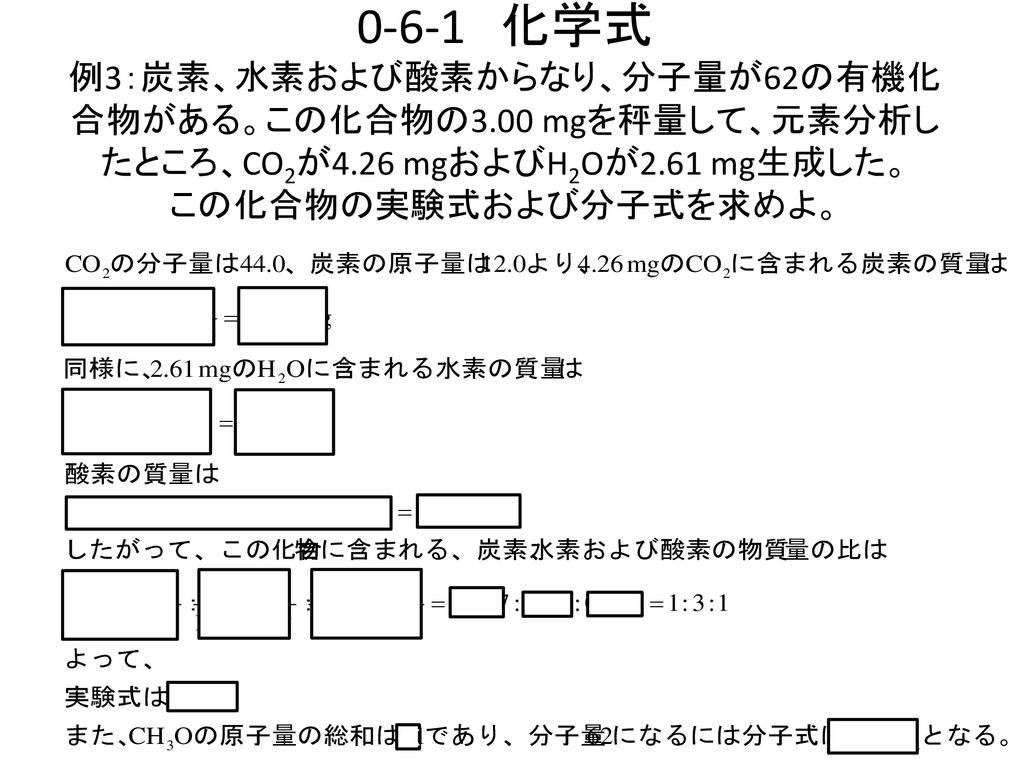



福井工業大学 原 道寛 学籍番号 氏名 Ppt Download




ある濃度の塩酸を 50ml 用い 加えるマグネシウム 2mg の質量を変え クァンダ Qanda で解き方を見る




実験式とは コトバンク




理科実験のページ 埼玉県立松山高等学校



マグネシウムと塩酸を反応させて水素を集める実験についてです 実際に捕集さ Yahoo 知恵袋



化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で




マグネシウム Mg



化学反応における物質の量的関係を調べる実験で 塩酸とマグネシ Yahoo 知恵袋



化学の質問です 例えば 2mg O2 2mgo原子量mg 24 Yahoo 知恵袋



マグネシウムを使って水素を発生させる実験で 写真の真ん中の マ Yahoo 知恵袋




高校化学基礎 過不足の計算1 映像授業のtry It トライイット




理工系のための化学実験 生物工学実験 東京電機大学自然科学系列 Hmv Books Online



化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で



化学変化と物質の質量4 質量変化の規則性 後編 理科とか苦手で




実験レポート Mgと塩酸の反応 楽しくチャレンジ




1分野 化学変化 原子分子 K S理科実験室 K S Science Lab



理工系のための 化学実験 生物工学実験 東京電機大学 自然科学系列 編集 学術図書出版社 版元ドットコム



永遠の定番実験 マグネシウムの還元 酸化反応




1分野 化学変化 原子分子 K S理科実験室 K S Science Lab
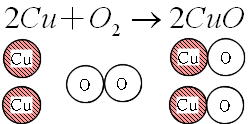



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ
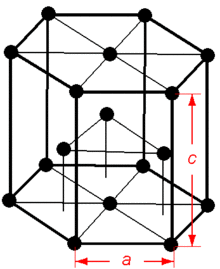



マグネシウム Wikipedia




永遠の定番実験 マグネシウムの還元 酸化反応
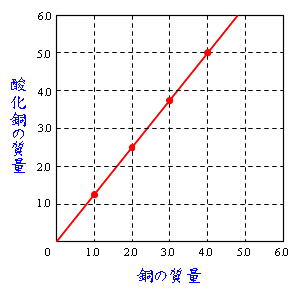



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ




7 12 6 1 100g I 10g 1 Descubre Como Resolverlo En Qanda
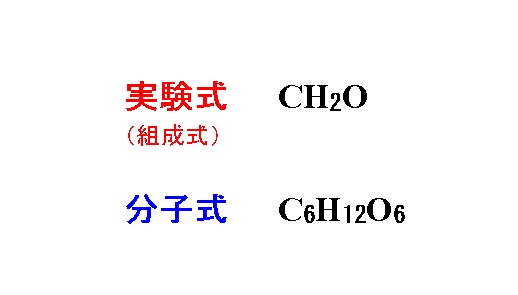



有機化合物の実験式 組成式 を求める計算と分子式の決定




酸化マグネシウム Wikipedia




ららマジ 約3年半 ありがとうございました 1 ららマジの話題 6 3 水 16時頃 ツイ速クオリティ Twitter




Mg Oh 2 水酸化マグネシウム Kojundoオンライン



中2化学 マグネシウムの燃焼 Sciencenote Jp




1g 1 80g Descubre Como Resolverlo En Qanda




問3がわかりません 答えは27です Clear



実習11 定比例の法則 2年理科 Takaの授業記録17




最も人気のある マグネシウム 原子量 人気の新しい最高の壁紙無料afhd




マグネシウム Magnesium にがりの成分から軽量化合物材料まで Chem Station ケムステ



原子番号12番のマグネシウムには3種類の安定な同位体が存在しその割合はおよそ Yahoo 知恵袋




中3化学変化です 2 の解説お願いします Clear



0 件のコメント:
コメントを投稿